类别:bob官方网站 来源:bob官方网站 发布时间:2024-11-08 11:01:37 浏览:1
在药物分析实验室中,溶出测试方法是一种最常见的分析技术,主要使用在于口服固体制剂的体外溶出测定。溶出测试可当作描述制剂特性的方法(如含量、有关物质)的补充。
首先,溶出方法应能够检测产品由于理化性质变化引起的药物释放速率或量的变化。这一些信息有助于建立批与批(batch-to-batch)生产一致性的质控。
译者注解:我们假设一种极端情况,如果片剂不能崩解,其中的活性成分不能溶出,即使含量与有关物质均符合相关规定,那也不会产生应有的药效。因此能看出溶出度是口服固体制剂的一项关键质量属性,评价它的就是溶出度检测的新方法。
溶出度检测方法需要能区分影响溶出度的关键工艺参数的变化,例如难溶性API的粒径(或粒径分布)、制粒参数、处方比例等。这些一般在不同批次间都有几率存在差异,溶出度方法应能区分这些差异。这就是溶出度方法强调区分力的原因。必须要格外注意的是,这和溶出速度快慢并不是必然的关系。同时溶出度方法也需要对贮存期间样品物理化学性质的变化具有一定的敏感性,例如晶型转变、自身聚集、脱水、吸湿等,如果这种变化可能会影响药物释放的话。
质量标准收载的溶出度方法应当满足上述两个要求,不强求需要有体内外相关性,这就是译文中“不是所有药物的溶出方法都能满足以上三个方面的功能”的情况。在研究阶段,会寻找具有体内外相关的溶出条件,但不一定可以找到。因为药物在体内产生药效有四个过程,即“溶出、吸收、分布、代谢”,溶出仅仅是其中一个环节,后面的三个环节并不一定与其有良好的对应关系。因此品质衡量准则中制定溶出度方法,更重要的是评价自身批内与批间的质量一致性,不要迷恋体内外相关。
对于一个非药典的产品(如新产品),尽可能开发一个标准药典溶出方法。在方法开发与验证中,应考虑EP、JP和USP的法规要求。尽管USP通常要求速释制剂(IR)测试单点的溶出度,但对于中等溶解和略溶的药物,在方法开发过程中仍需测定多时间点的溶出数据以更好研究产品的特性。
本章概述了药物溶出方法验证的一般要求。溶出方法的开发和验证阶段与其他测试方法一样,都不是很明确的。因此,本章有时会论述一些关于开展调查的补充意见。这个讨论是基于小分子药物的方法验证,着重关注制药行业的现行法规要求。因为方法验证贯穿于产品研究开发过程中的不同阶段,因此本章提供的信息一般适用于根据ICH指导原则准备提交注册申请(如NDA)时进行的最终溶出方法的验证。
溶出方法有两个步骤:样品制备和样品分析。本章“样品制备”是指样品溶出的过程,包括样品液的收集。从溶出装置收集的样品液可能直接做多元化的分析或要进一步处理(如稀释)获得最终的样品液。
译者注解:溶出包括两个过程:溶出取样与分析。在做溶出方法验证的时候应对这两个过程都进行一定的验证。目前我们大多将方法验证的重点放在分析这块,忽略了溶出取样过程的验证。
含有新化学实体(NCEs)的固体口服制剂通常制成片剂或胶囊。NCEs后续开发可能会研究其更特殊的药物递送系统。标准的口服片剂或胶囊的溶出方法通常使用桨法或篮法装置。在这章中我们主要关注使用这两种装置进行方法开发和后续的方法验证。
验证要求包括溶出样品制备和样品分析。本章重点讨论溶出方法验证的需要注意的几点。验证是为了评估拟定测试方法的性能。任何成功的验证结果都是一组全面数据,能够支持方法的预期目的。因此,执行一个没有明确计划的验证会遇到许多困难,包括产生不完整的或有缺陷的验证数据。有计划的验证必须包括以下内容:确定需要评估的项目(strategy)、如何评估每个项目(experimental)和预期最低标准(criteria)。强烈推荐准备一个清楚规定实验操作和相应接受标准的验证方案。方法验证必须包括样品制备和样品分析的评估。ICH Q2A(1)提供了溶出方法验证的指导原则,见表4.1。
溶出方法验证要求与含量方法验证是相似的,虽然没有在表4.1中列出,但应该评估方法中不同参数的耐用性(如样品溶液的稳定性),这些要求详见2.4章节。
当使用篮法装置时,应将样品放在干燥的篮里,篮固定在连接的圆盘上,然后降低至规定的位置,立即开始转动。当使用桨法时,样品应在溶出杯的底部,立即按规定转速开启桨。如果要求使用沉降装置(Sinker),样品应放在沉降装置中,使其沉于溶出杯底部。在合适的时间点取样,用合适的方法滤过,滤液作为样品溶液。分析样品溶液中的药物,以相对标示量的百分含量表示规定时间的溶出量。

三大药典中关于篮法和桨法装置的要求是相似的,但也有一些不同。这些常见的要求汇总见表4.2。在方法开发时,知道这些差异是很重要的。在溶出装置定期校验时,其中的一些特征指标(如杆的位置,杆的转速变化和桨到溶出杯底部的距离)会作为系统检查。
通过观察制剂的溶出现象,可以在不进行样品分析时就能很快的发现处方或溶出方法的问题。这在处方开发和方法开发前期是特别有用的,当筛选多个处方或多种溶出介质时应进行考虑。
在方法最初开发阶段,溶出方法的定性评估能节约大量的时间,某一测试的要求没有满足,可以不进行样品分析。一些可能观察到的剂型性能和有关问题如下:
胶囊壳或片剂的包衣开始破裂需要的时间,这提示胶囊壳或包衣可能会导致药物延迟释放的问题(如明胶的交联作用)
完全崩解需要的时间,暗示剂量单位可能会影响活性成分的释放(如过度压制的胶囊粉末或片芯)。
在溶出杯内混合的效果。堆积(在溶出杯底部形成一堆不溶性的辅料颗粒)在大多数情况下要更高的转速或用不同的装置(用篮法代替桨法)。
表4.3显示胶囊剂的溶出结果。通过一系列实验研究两种沉降装置。当使用不相同沉降装置时,通过溶出试验的定性评价比较胶囊的溶出行为。沉降装置B是这个处方的最适宜装置。一旦使用这个最适宜沉降装置重复试验,溶出试验就会显示出良好的低变异性结果。
应采用不同的方法来验证溶出测试中的样品制备过程。验证的目的是为了证明这样的解决方法是符合其预期目的的。例如,一个策略是,在方法开发时(方法正式验证前)证明不同样品制备方法的有效性。最后的验证将会确认方法开发时所作的工作。方法开发和验证过程遵循的策略取决于分析实验室的文化、专业化程度和策略。
译者注解:方法验证的结果如何,在方法开发阶段已经决定了。方法验证时只是将开发好的方法以数据证明其合理性。这是QbD理念在方法开发验证中的体现,在方法开发阶段对办法来进行适当的风险评估,可以大幅度减少方法验证出问题的可能性。比如溶出取样常见的风险包括:滤膜吸附、API在介质中的稳定性、仪器参数如温度的偏离等。在方法开发阶段进行了相应的验证,就保证了方法验证的顺利完成。并还有一些未描述的基于对样品了解可能存在的其他风险也有必要进行评估。这些理念并不只是用于溶出取样阶段,其他检测的新方法的开发验证的理念也是相通的。
剂型的性质将决定方法开发和验证时使用的溶出装置的类型。当选择溶出装置时一定要了解下面的问题:
USP溶出装置1(篮法)和2(桨法)通常用于速释制剂。USP装置3(往复筒法)是测试缓释制剂或要求多个pH的溶出曲线和时间点剂型的选择。小剂量的产品可能要求使用流池法分析或小体积测试技术(非药典规定的100、200mL溶出杯)。在方法开发时,一旦装置被选择且证明是合适的,那么在方法验证时就不需要再评估其他的装置。
水、盐酸(0.1N)和不同pH缓冲盐是常用的溶出介质。尽管水是常用的溶出介质,但因为水没有控制pH,应避开使用。水的pH受处方组成(包括活性成分)的影响很大。缺少pH的控制可能导致溶出曲线发生改变。辅料发生明显的变化或因制剂降解而发生的变化可能会导致pH的改变。盐酸(0.1N)常作为溶出介质使用,因为其可以模拟胃的酸性环境。其他溶出介质(如pH4.5或6.8缓冲液)可拿来模拟患者的胃的状态(如空腹或进食)或改善释放曲线特征和/或区分力。对于低溶解性药物,可使用表面活性剂(如吐温80)来改善溶出曲线。
脱气在溶出方法开发和验证中是很重要的因素,因为它可以影响药物的释放速度。理想情况下,一个方法不应该受脱气方法的影响。至少应证明脱气程度不会显著改变溶出试验的结果。必须要格外注意的是,含有表面活性剂的介质不应被脱气,因为这可能会引起过多的气泡产生。
真空通常应用在溶解介质过滤后,滤液持续暴露于真空泵所产生的低真空中(加热或不加热)。真空泵的水压力(例如真空度)可能会影响这种脱气的方法。应该确保有足够的吸力。需要注意暴露的时间。
氦气脱气法常用于去除HPLC流动相中溶解的气体。同样的原理能够适用于介质的脱气。需要注意吹氦气的时间,因为它是溶出试验的一个关键参数。
加热是这三种方法中最不常用的溶出介质脱气方式。这种技术中,过滤的介质要加热到37℃以上(达到约90℃),并不断搅拌使溶解的气体消失。温度和时间间隔是确定脱气程度的重要因素。
通过测定介质中最终的含氧量,能确定脱气技术是否有效。应在使用介质前进行脱气,以免再溶解气体。然而在使用前脱气,并不是可行的。因此,应该有数据支持使用某一些程度上在空气中再暴露介质的结果及可接受溶解氧的水平。
译者注解:溶出度方法验证很少验证溶出介质的脱气,比如验证脱气的方式和程度。但这并不说明该项一定能不用研究,如果脱气程度对溶出结果有非常大的影响,则应对脱气进行相应的验证。检测方法涉及的某项操作是否需要验证,取决于该项操作对结果可能产生影响的程度,即风险的高低。方法验证中需要验证的内容,应该是基于我们对方法的了解,基于风险的判断。
在溶出方法的开发和验证中,篮法或桨法的转速是一个重要因素。篮法常用100rpm,桨法常用50rpm。方法验证中,需要确保转速的微小变化不会影响溶出试验结果。药典规定的转速在±4%内变化,但是方法耐用性应考虑更大的变化(如±10%)
译者注解:耐用性验证的区间应该考虑较大的范围,使方法在不同仪器上都有良好的重现性。不要说仪器已经做了机械性能的验证,就能不用做相关耐用性验证了。仪器机械性能验证只是说明仪器的机械性能的偏差在允许的范围内,而耐用性是证明这种偏差不会对检测结果产生影响。
在方法开发和验证时,需要考虑在质控实验室建立自动或手动取样的可行性。如果选择自动取样,必须证明等同于手动取样。
在自动取样系统中,管路中有残留可能会引起正偏差。对于这一点必须进行调查确认是否发生残留,并在可接受范围内。根据残留量的大小,可能需要为系统制定一个特定的清洗程序,确保残留量降低至最小。
另一方面,管路的吸附作用将会引起负偏差。如果这个偏差太高,可能有必要规定样品取样只能为手动方法。
最后,比较自动和手动取样时,应该考虑取样探头可能会改变杯内的流体动力学。理论上,取样探头只有在取样时才可以浸在溶出杯中。
溶出样品收集时需要过滤。过滤掉可能干扰样品分析的辅料是很有必要的。进行适当的回收率研究和记录是必要的。任何观察到的偏差都应该进行说明。过滤必须在取样时进行,而不是在过一段时间以后。
译者注解:手动取样和自动取样应评估结果的一致性。自动取样存在管路吸附和残留的风险,需要评估可能会产生的影响,并制定相应的处理措施。
新处方研究的溶出方法的开发和验证通常会使用到非药典方法(如peak杯、特殊沉降装置)。在方法开发和验证过程中,应评估这一些方法的适应性。
一旦清理洗涤干净溶出杯后,有必要进行“空白”的溶出测试,以确保溶出杯的清洁方法是适当的,不会引起污染。
在方法开发或验证时,或在测定方法中,任何的清洁方法都必须确认。在实验设计中,可研究样品取样过程的耐用性,研究所有或部分之前讨论的参数。表4.4显示了44次影响因素试验设计统计分析的数据。设计试验研究脱气、介质浓度、桨高度、桨转速和取样时间的影响。在此方法中,模拟了方法操作条件的正常变化。
介质浓度、桨叶高度和沉降装置因素的p值表示无显著影响(p值0.05)。然而,即使观察到在介质脱气、桨转速和取样时间方面的统计意义,但这些影响是微不足道的。
译者注解:可以借鉴这个表做相应的取样参数耐用性验证,但不必完全一致。比如介质浓度,如果介质浓度产生偏离的风险很小,就不必验证。
如前文所述,溶出分析方法的验证将根据指导原则进行,类似于第2章节的描述,验证参数已进行了详细的讨论。本章着重强调溶出方法的验证要求。
制备覆盖样品浓度的系列标准溶液。ICH Q2B建议±20%范围。通常从25%-125%的正常浓度范围进行线性测试,这个范围覆盖了早期的溶出时间点。目测响应相对于浓度应是一条直线。应报告相关系数(r)、残差和y轴截距。对于缓释产品的溶出曲线%浓度。例如,对于溶出度为20-90%的释放曲线%。
准确度是对已知浓度的样品溶液(如加标样品)进行测定。在进行实验时,线性和准确度溶液可能使用相同的储备溶液。准确度溶液必须在正常试验条件下进行(如在加热的溶出杯内混合)。测定取样和分析样品溶液引起的偏差。如果产品需要测定溶出曲线,需在不同浓度下进行准确度的测试(如在理论溶出量的40%,75%和110%),结果以百分比的形式表示。
中间精密度是指不同的分析者及不同的仪器设施制备6份溶出样品进行中间精密度测定。然而,这样的一个过程无法区分方法变化和片与片的变化。它将预测最坏情况下的精密度,包括片与片之间、取样和分析的变化。
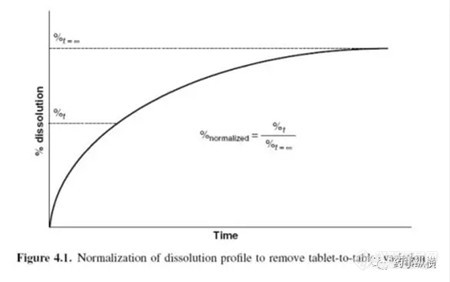
测定缓释处方多个取样点的溶出曲线的精密度,通常最后一个取样点可以消除片与片之间和批次之间的差异。图4.1阐明了扣除片与片之间的差异的标准溶出曲线,然而标准的技术仅作为研究手段用于方法开发。最后处方应该在最后时间点完全释放。能够正常的使用该办法来进行标准化,以消除批与批之间的变化,公式如下:
溶出度测试的线性、准确度和精密度结果有助于范围的确定(单点理论溶出的25%-125%,缓释产品溶出曲线%)
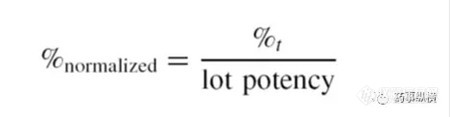
在分析方法验证时,应研究波长准确性、波长重复性,稀释溶剂(如pH、浓度)、溶液稳定性和脱气情况。
对于HPLC分析,应该证明原料与辅料、系统干扰峰是可以分离的。对于UV-Vis分析,空白辅料的吸收不应太大。必须要格外注意的是,溶出方法不需要具有稳定性指示能力、不必将降解物峰与被分析物分离。
译者注解:溶出度结果允许较大的误差,我们该注意到溶出度的可接受标准都是整数,不同于含量测定的小数点后一位的可接受标准。因此较小量的杂质对溶出结果的影响可忽略,比如品质衡量准则中总杂不得过1.0%之类,在进行专属性验证时可不验证已知杂质的分离情况。个人觉得含量测定方法验证也是同理,之前含量测定很多用紫外进行仔细的检测,这种方法并不能排除杂质的干扰,应当是忽略掉了。
在溶出方法的生命周期中,很多情况要求进行方法的再验证。这些与第2章节中的含量测定是相似的。
以下我们总结了溶出方法中常见的缺陷,在方法验证中有几率会使一些问题。关于分析部分的普遍的问题与第2章节中含量测定是相似的。
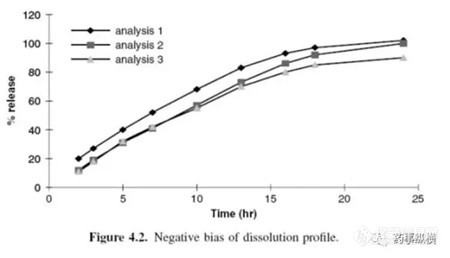
?样品溶液的组成与对照品溶液不匹配,导致样品出现较低的响应。这可能是由于对照品溶液和样品溶液制备方法不同或溶出介质中的负基质效应引起的(如pH改变)。
溶出过程中或溶出后阶段发生了样品降解,与对照品溶液相比,改变了样品溶液的响应。
?计算多点(曲线)的样品分析,前面取样点没有校正样品和介质体积的变化引起的偏差。这种偏差随着取样体积和取样时间的增加而增加。
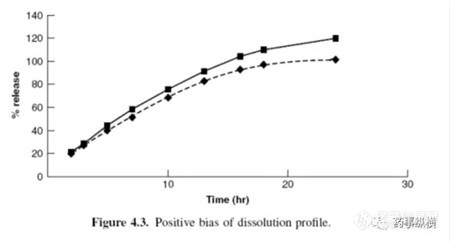
?如果使用UV-Vis直接测定,相比依赖降解物吸收的对照品,样品溶出过程中或溶出后阶段发生了降解,改变了样品溶液的响应。
?样品溶液的组成与对照品溶液不匹配,导致样品溶液有高的响应偏差。这可能是由于对照品溶液和样品溶液制备方法不同或溶出介质中的正基质效应引起的(如pH改变)。
?蒸发损失会导致偏差结果,特别是对于延长溶出周期的情况(如从几小时至几天)
溶出仪应定时进行校验。每次进行溶出试验时,应该检查校验状态和校验的有效期。
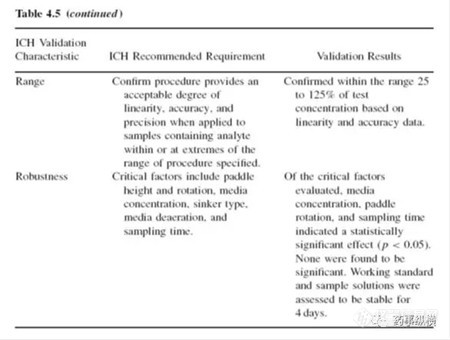
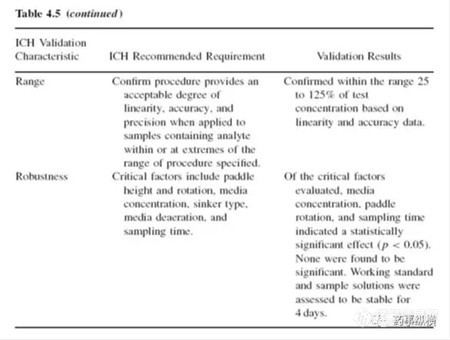
应采用表格的方式对溶出方法验证进行总结,这可以快速浏览验证数据。表格中应列出ICH规定的详细验证要求和验证结果。总之,支持方法验证的必要数据都应包括。表4.5是一个例子:
译者总结性的注解:溶出方法的验证应包括两大块:一是溶出取样过程的验证,包括溶出介质处理(脱气、不同成分的加入顺序等)、供试品在溶出介质中的稳定性、不一样仪器(如自动取样与手动取样)、不一样的品牌仪器的结果一致性验证、仪器参数的耐用性验证(温度、转速等)、过滤操作的验证(滤膜和注射器吸附)、取样时间(自动取样可省略)等。另一块是分析方法的验证,这块内容著述非常多,就不再赘述。
European Pharmacopoeia, 4th ed., Section 2.93, Dissolution Test for Solid Dosage Forms, 2002.
Japanese Pharmacopoeia, 14th ed., Chapter 15, Dissolution Test, pp. 33–36, 2001.
![]()
![]()
宁波海关技术中心892.00万元采购离子色谱仪,气相色谱仪,液相色谱仪
七台河市民政局170.00万元采购血球分析仪,生物安全柜,细胞计数器,酶标仪,冷藏柜,培养箱
宁波市镇海区卫生健康局294.96万元采购生物安全柜,研磨机,冷藏柜,超声波清洗器,超低温冰箱,OR...
西安交通大学第二附属医院659.00万元采购基因测序仪,流式细胞仪,PCR
北京市结核病胸部肿瘤研究所226.49万元采购活体成像系统,核酸提取仪
石家庄海关技术中心2397.00万元采购ICP-AES,熔样机,有机元素分析,离心机,凝胶色谱仪,紫...