类别:新闻中心 来源:新闻中心 发布时间:2023-12-15 07:22:52 浏览:1
此次IPO,泛生子共发行1600万股美国存托股(ADS),每股公开发行价格为16美元,合计募资约2.6亿美元 (绿鞋前),达成全球历史上最大规模癌症精准医学公司上市项目(按绿鞋前计)。
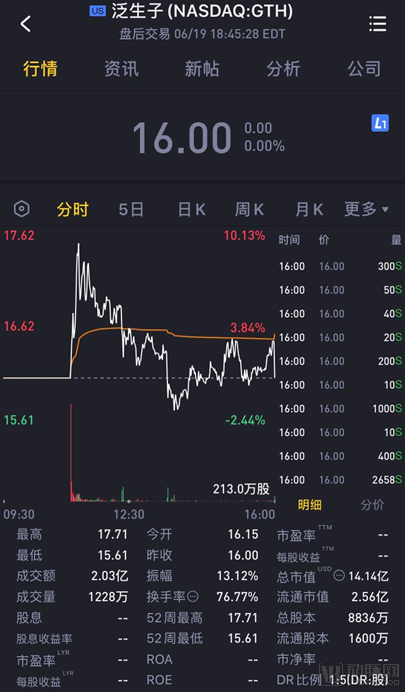
泛生子今日上市开盘价格小涨至16.15美元。开盘后迅速上涨,最高触到17.71美元。到当天收盘,泛生子股价停留在16美元,总市值达到14.14亿美元,折合人民币约100亿。

创业至今,泛生子已完成了四轮融资,总额超过10亿元人民币。2019年最新一轮的融资中吸引到了维梧资本、中金资本及Alexandria Venture Investments等多家知名投资机构领投,弘晖资本及现有股东跟投。
就在新一轮融资完成的第二天,泛生子立刻向纳斯达克交易所首次递交了自己的招股说明书,也因此成为了第一个递交上市申请的肿瘤NGS伴随诊断企业。当时动脉网就对泛生子招股书中披露的信息进行了深入的解读,具体分析了泛生子的财务数据和商业模式。
2020年6月,泛生子又更新了一份招股书,主要是更新了2019年四季度和2020年一季度的财务数据。对比前后两版招股书,我们注意到两个关键变化。
同时胡云富博士还曾在全球一流的诊断及制药公司从事产品研究开发工作十余年。因此他不仅熟悉产品审批流程,在精准医学研究、肿瘤生物标志物开发等方面也颇有建树。
胡云富加入泛生子后出任首席医疗官,一方面将自己多年在审评审批上的经验应用于泛生子体外诊断器械产品的注册,与我们后文将分析的泛生子的入院路径非常契合;另一方面则提高泛生子对药企药物研发的赋能能力,这也是泛生子目前的发力点之一;此外,其丰富的FDA监管经验将非常有助于推动中国癌症精准诊断领域的行业标准化、规范化发展。
另一个关键变化在于,泛生子招股书中对于HCCscreen早筛产品的描述中添加了ctDNA甲基化相关的信息。
在前一版的招股书中,泛生子对自身HCCscreen早筛技术的描述为“同时使用ctDNA变异和蛋白质生物标志物做多元化的分析”,而在最新的招股书中,改描述变成了“检测ctDNA突变和甲基化改变以及蛋白生物标志物的组合”。
熟悉泛生子的人就会比较了解,泛生子在DNA甲基化早筛领域其实一直有布局。
HCCscreen方法的核心技术是Mutation Capsule。Mutation Capsule可以检测到广泛的ctDNA变异,从简单的点突变、插入,到较复杂的易位、HBV整合、甲基化变化等。这一些内容在泛生子的初版招股书中就有清晰描述。泛生子当前正在进行的多达4500人的大队列肝癌早筛研究,也已经将甲基化变化纳入到了检测靶标之列。
因此此次HCCscreen的信息更新,只是更加清晰的表达了HCCscreen覆盖的分析维度。
LDT(实验室检测)模式可以称得上最适合肿瘤NGS伴随诊断的服务模式。尤其是大panel的NGS伴随诊断产品,其检验测试范围、检测深度、相关算法等各种指标,会随着检测量的提高而一直在升级迭代。LDT模式能够保证检测企业始终为患者提供的是最新,最前沿的检测内容。
根据不同患者的不一样的需求,泛生子已经根据Panel大小和不同瘤种,构建了一组适用于不同应用场景的产品系列。所有这些技术和产品构成了泛生子在LDT服务方面的布局,并且在细分瘤种的布局上,非常有自己的特色。

大多数同类公司可以提供的肿瘤伴随诊断产品都只适用于FFPE(石蜡包埋组织)样品和血液样品的检测。而泛生子则在这两大范围之外,拓展出了尿液和脑脊液检测。这也让泛生子在膀胱癌和脑肿瘤这两大瘤种上实现了行业内的领先地位。
尿液液体活检相对更常见一些。传统的膀胱癌诊断方法需要借助侵入性的膀胱镜检或者输尿管镜检,尿液液体活检则实现了膀胱癌的无创诊断。就在2020年,泛生子的尿液液体活检研究成果还登上了AACR(美国癌症研究协会)年会,在75例尿路上皮癌病例、75例良性泌尿系统疾病病例和100例健康个体中,实现了94%的敏感性和96%的特异性。
脑肿瘤相对更特殊一些。泛生子起家于脑肿瘤研究和产品研究开发,其发现了IDH1和TERT两个基因突变常见于胶质瘤中,而胶质瘤就是最常见的脑肿瘤类型。由于血脑屏障的存在,以血液为基础的ctDNA检测并不能很好的反映脑肿瘤的真实情况。因此泛生子选择通过脑脊液进行有关脑肿瘤的ctDNA检测,并且已经实现了97.3%的检出率。
在更大的肿瘤伴随诊断市场上,Onco PanScan才是泛生子真正的拳头产品。Onco PanScan适用于所有实体瘤患者,包括新诊断的患者,耐药患者和疾病复发患者,可以为患者提供点突变、插入、融合蛋白、TMB(肿瘤突变负荷)、MSI(微卫星不稳定性)等全方位的评估指标。而且该产品同时兼容Illumina和华大智造的测序平台,使得该产品的应用场景又拓宽了一些可能性。
随着新药获批、临床指南更新以及泛生子自己的研究成果,Onco PanScan也在持续迭代。最近一次的大更新发生在2018年12月,其规模已经扩大到覆盖了831个基因的大Panel。
在本次招股书的更新中,泛生子也披露了与Onco PanScan有关的一件大事。2019年12月,广东省临检中心批准Onco PanScan开展试点运行。这也是国内首个大Panel的肿瘤NGS伴随诊断试点。
针对自己提供的检测服务,泛生子在技术上进行了也进行了一系列革新。比如Genetron One-Step Seq技术,可以在极短的时间内完成高质量的文库构建,将建库时间控制在1.5小时;液体活检低频突变检测技术,可以让建库生产的样品特异性更强,防止PCR扩增和测序过程中产生的假阳性;AI和大数据技术则保证了泛生子的生物信息学能力,持续提升产品的灵敏度和准确性。
泛生子多样化的产品组合契合了不同肿瘤患者的需求。从2017年1月1日到2020年3月31日,三年半的时间内,泛生子已经通过LDT模式已经为肿瘤患者提供了50000多个检测服务。
虽然相比于IVD,LDT模式显然更适合算法不断迭代的肿瘤NGS伴随诊断。但是目前为止,国内的相关这类的产品一定要获得三类医疗器械许可证,才能名正言顺的进入医院,为患者提供诊断依据。
而且就中国的国情而言,肿瘤患者寻求治疗的途径几乎只有医院这一个选项。因此肿瘤NGS企业想要打通自己的产品营销售卖渠道,就必须要与医院之间形成高黏度的合作关系。

医院诊疗过程中的相关用品,必须要获得医疗器械注册证。因此泛生子从2017年开始,就逐步将自己的产品向医疗器械注册证的方向上推进。从整体规划上,泛生子按先后顺序推进三大类不一样的产品的注册报证,分三步逐级深入院内服务。
第一步,率先通过审批的正是IDH1和TERT基因的相关检测试剂盒。这两款试剂盒使用PCR的方法即可进行仔细的检测,医院的病理科无需通过额外的培训,就可以熟练的使用这两款产品。
在当时大多数同类企业都聚焦于肺癌、消化道肿瘤等大瘤种时,泛生子提供的胶质瘤检测试剂盒在市场上独树一帜,很快便打开了医院的大门。泛生子的招股书中提到,这两款产品已经被批准在浙江、广东、四川和山东等十个省份进行阳光集中采购。
第二步,在通过PCR产品提升个人在医院方面的知名度后,泛生子开始布局仪器设施方向,为医院提供更深入的检测服务。生物芯片阅读仪、中、高通量NGS测序仪和全自动加样系统的接连拿证,让泛生子完成了自己在检验测试领域的仪器平台布局。包括测序过程中使用的试剂、试剂盒、采样器等,泛生子也都已经在有关地区的药监局进行了备案。泛生子提供的检测服务中,从仪器设施,到相关用品,几乎全部实现自主生产。这样一方面有利于控制成本提高毛利率,另一方面,也能更好的保证自身的产品质量。
而且在强大的设备平台加持下,泛生子能够在一定程度上帮助有需求的医院提升个人的分子诊断能力。泛生子已经组建了一支专门的团队,为医院提供从实验室设计、设备采购,到系统安装、后期培训的全流程院内分子诊断中心开发服务。而提供这种服务的基础,自然是一整套已经获得医疗器械批件的仪器设施平台。
第三步,更多更具深度的伴随诊断产品开始顺次通过审批,持续赋能检验测试平台。有了检测平台之后,需要更多样,覆盖面更大的检验测试产品,才能发挥检验测试平台的优势。推动更多适应不一样场景的检验测试产品通过审批,正是泛生子当下着力推进的工作。
作为先头部队的“人类8基因突变联合检测试剂盒(半导体测序法)”已经在2020年2月顺利获批。泛生子的招股书中显示,其产品管线中的另外三款产品也已确定进入到了临床试验阶段,到临床试验顺利完成,就可以开展产品注册活动。

目前来看,泛生子三步走的策略已经初步成功。截至招股书发布,泛生子已经与30多家医院达成了合作,其中17家医院达成了院内检验合作。而随着行业内竞争的逐步深化,自主生产的临床级检验平台,只会让泛生子在院内服务方面的优势越来越大。
肿瘤早筛是这两年肿瘤NGS伴随诊断行业最热门的话题之一,作为行业头部企业的泛生子自然也提早进行了相关布局。
在早筛的布局上,泛生子很早将自己的目标锁定在了肝癌领域,集中攻破这一肿瘤治疗上的难题。
肝癌与HBV感染高度相关,中国大约有7390万HBV携带者,这正意味着HCCscreen的巨大市场潜力。泛生子的HCCscreen使用血液活检进行肝癌早筛,核心是通过检验测试无症状的HBV(HBsAg)阳性个体的表面抗原,来在早期发现HCC(肝细胞癌)。
HCCscreen目前已经取得了阶段性的成果。在一项331名无症状HBV携带者参与的前瞻性队列中,HCCscreen鉴别了24例阳性病例,其中有4例在6个月的随访中被诊断出患有HCC,并且四例病例均处于早期(肿瘤<3cm);而其余307个在12个月的随访中,都没有肝癌发生。据此数据HCCscreen实现了17%PPV(阳性预测值),100%敏感性和94%特异性。
泛生子正在不断地迭代HCCscreen,将甲基化变化也纳入考量的指标中。目前正在进行的一项多中心队列研究,将涉及4500多名HBV阳性的个体。
泛生子在肝癌早筛上的工作也得到了相关政府部门的肯定,已经获准加入科技部牵头的“艾滋病和病毒性肝炎等重大传染病防治科技重大专项”,负责肝癌早筛生物标志物的鉴定和开发,并验证肝癌早筛检测产品。
泛生子同时也在招股书中表示,在未来的三到五年中,将把近期的研发工作集中在涵盖肝癌,肺癌和消化道癌症的早期筛查上,并预计将以IVD产品的形式进行注册,其中肺癌和消化道癌研究已被列入科技部国家重大专项。

与药企的合作是目前泛生子开始发力的领域。利用基因组学等分子检测技术,可有明确的目的性的设计临床试验方案,缩短药物研发周期。
泛生子与药企之间的合作方式多种多样。最常见的自然是为药企的临床试验提供伴随诊断服务,或是利用特定的分子靶标分选入组患者;泛生子还可以凭借出色的研发能力针对药企在临床试验上的需求,进行定制化的检验测试产品研发;生物标志物是近几年药品领域的热门话题,泛生子的研究体系可以帮助药企进行生物标志物开发;基于自己独特的技术内核,泛生子为其他企业提供技术上的帮助,像是脱靶效应分析。
基于以上几大类的合作模式,截至最新的招股书发布,泛生子已经与26家生物制药公司达成了合作,这一数量处于同行业的领先位置。
2020年2月6日,泛生子对外宣布已完成了新冠病毒核酸检测试剂盒的研发。
随后在武汉火神山医院的搭建过程中,3月上旬,泛生子向火神山医院捐献了一台GENETRON S5测序仪及配套产品。该仪器也成为了当时火神山医院唯一一台二代基因测序仪。
而在国内疫情逐渐平息之后,泛生子也将自己的目光转向国外,希望能通过自己的技术为全球疫情的防控做出贡献。
6月6日,泛生子自主研发的新冠病毒核酸检测试剂盒“Genetron SARS-CoV-2 RNA Test”获得了美国FDA签发的紧急使用授权和欧盟CE认证,并已进入中国医药保健品进出口商会新冠检测试剂类生产企业清单(医保商会白名单)。

泛生子在2019年依旧保持了其增长态势,总营收来到了人民币3.23亿元的新高点,较2017年增长约319.8%,年复合增长率约78.7%。
值得关注的是,2017年至2019年,泛生子的毛利率从26.7%,迅速增长到了44.9%。这也说明泛生子选择的全流程自主生产的方式,在提高毛利率上确实起到了非常显著的效果。
2020年一季度,疫情期间泛生子的营收不仅没有受到影响,反而实现了15.3%的同比增长。这与泛生子在疫情期间的一系列动作密不可分。2020年前三个月的毛利率进一步扩大到了54.6%,主要是因为疫情期间泛生子的IVD产品实现了营收上的快速增长,这一部分的毛利较高拉动了整体毛利上涨。
在疫情期间同样没有停止的,还有泛生子的研发投入。最新一版的招股书中显示,2019年泛生子的研发支出已经达到了约9170万元。而在2020年前三个月,研发支出进一步放大,环比增长42.3%。

泛生子本次上市募集资金将用于技术和产品研制、市场开拓以及用于满足营运资金和一般公司用途。招股书显示,泛生子计划将高达40%的募集资金投向研发领域,主要用于基础科研、IVD产品注册和早筛技术研发。
在多年的发展中,泛生子已经基本摸索出了一条对自己最合适的路线和打法。LDT产品作为主线服务有需求的患者;IVD产品注册申报打通院内途径;肿瘤早筛以肝癌为突破口寻求发展。几条业务线互相配合,形成属于泛生子的肿瘤精准诊疗网状布局。