行业新闻


医疗器械改变流程图轻松搞定II、III类批阅!
类别:行业新闻 来源:行业新闻 发布时间:2023-11-14 21:32:50 浏览:1
依据《医疗器械监督处理条例》的规则,中华人民共和国境内的医疗器械依照危险程度分为三类:第I类、第II类和第III类。
关于第II类医疗器械,它们具有中度危险,需求严控处理以保证其安全、有用的医疗器械。境内出产企业要在所在地省(直辖市)药监局进行注册,而境外医疗器械出产企业要托付境内署理人在国家药监局进行注册。
第III类医疗器械具有较高危险,需求采纳特别办法严控处理以保证其安全、有用的医疗器械。不管境内、境外医疗器械出产企业均需求在国家药监局进行注册。
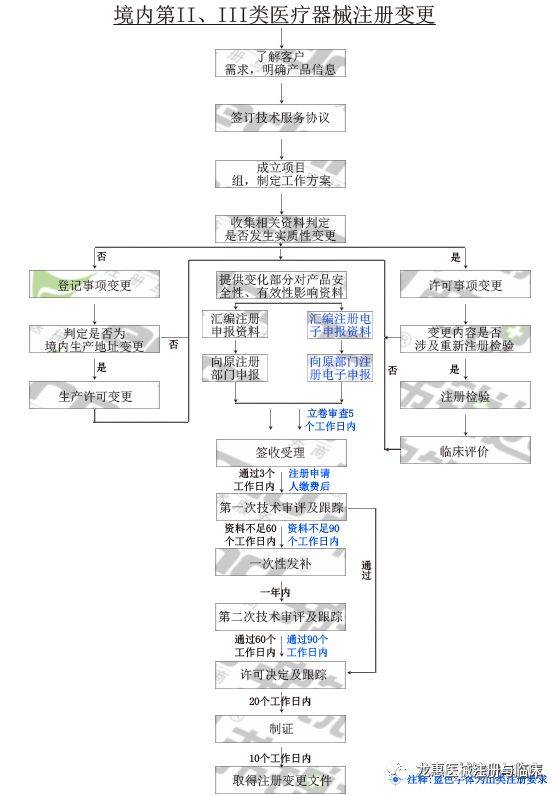
已注册的第二类、第三类医疗器械产品,假如其规划、原材料、出产的根本工艺、使用范围、使用方法等产生实质性改变,有或许影响该医疗器械安全、有用的,注册人应向原注册部分请求处理改变注册手续。相反,假如产生非实质性改变,不影响该医疗器械安全、有用的,应当将变化状况向原注册部分存案。
9、《境内第三类医疗器械注册质量处理体系核对作业程序(暂行)》(食药监械管〔2015〕63号)